onde os valores devem ser submetidos ao sistema categorial Graceli.
Matriz categorial de Graceli.
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
Tipos, níveis, potenciais, tempo de ação, temperatura, eletricidade, magnetismo, radioatividade, luminescências, dinâmicas, estruturas, fenômenos, transições de fenômenos e estados físicos, e estados de energias, dimensões fenomênicas de Graceli.
trans-intermecânica de supercondutividade no sistema categorial de Graceli.
EPG = d [hc] [T / IEEpei [pit] = [pTEMRLD] and [fao] [itd] [iicee] tetdvd [pe] cee [caG].]
p it = potentials of interactions and transformations.
Temperature divided by isotopes and physical states and potential states of energies and isotopes = emissions, random wave fluxes, ion interactions, charges and energies structures, tunnels and entanglements, transformations and decays, vibrations and dilations, electrostatic potential, conductivities, entropies and enthalpies. categories and agents of Graceli.
h e = quantum index and speed of light.
[pTEMRlD] = THERMAL, ELECTRICAL, MAGNETIC, RADIOACTIVE, Luminescence, DYNAMIC POTENTIAL] ..
EPG = GRACELI POTENTIAL STATUS.
[pTFE] = POTENCIAL DE TRANSIÇÕES DE FASES DE ESTADOS FÍSICOS E DE ENERGIAS E FANÔMENOS [TRANSIÇÕES DE GRACELI]
, [pTEMRLD] [hc] [pI] [PF] [pIT][pTFE] [CG].
EPG = d [hc] [T / IEEpei [pit] = [pTEMRLD] and [fao] [itd] [iicee] tetdvd [pe] cee [caG].]
p it = potentials of interactions and transformations.
Temperature divided by isotopes and physical states and potential states of energies and isotopes = emissions, random wave fluxes, ion interactions, charges and energies structures, tunnels and entanglements, transformations and decays, vibrations and dilations, electrostatic potential, conductivities, entropies and enthalpies. categories and agents of Graceli.
h e = quantum index and speed of light.
[pTEMRlD] = THERMAL, ELECTRICAL, MAGNETIC, RADIOACTIVE, Luminescence, DYNAMIC POTENTIAL] ..
EPG = GRACELI POTENTIAL STATUS.
[pTFE] = POTENCIAL DE TRANSIÇÕES DE FASES DE ESTADOS FÍSICOS E DE ENERGIAS E FANÔMENOS [TRANSIÇÕES DE GRACELI]
, [pTEMRLD] [hc] [pI] [PF] [pIT][pTFE] [CG].
Propriedades ondulatórias das partículas
Em 1923, o físico francês Louis Victor de Broglie postulou o comportamento ondulatório da matéria:
"Em virtude de os fótons terem características ondulatórias e corpusculares, talvez todas as formas de matéria tenham propriedades ondulatórias e também corpusculares."
Esta foi uma ideia proposta, diferentemente das propostas por Thomson, Rutherford e Bohr, que não tinham evidências experimentais.
Este postulado diz que os elétrons têm também natureza dupla de partícula e onda, sendo acompanhados por uma onda.
Para a frequência f e o comprimento de onda λ da onda, associado ao elétron, ele propôs as equações
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
onde p é o momento e E a energia do elétron.
Note que a primeira equação é a de Planck, E=hf, para o fóton, agora utilizada para o elétron, e que a equação para λ também vale para
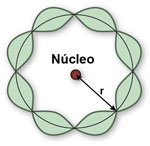
fótons e elétrons. Para os fótons temos que
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
Utilizando a relação entre energia e momento da relatividade especial, E=pc, temos:
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
As equações de Louis de Broglie foram propostas para qualquer tipo de matéria. Para corpos macroscópicos, os comprimentos de onda de Broglie são tão pequenos que impossibilitam a sua observação pela interferência ou pela difração. Calcule o comprimento de onda de uma partícula de massa 1g e velocidade 1.000 km/h.
Em 1927, experiências de difração realizadas com elétrons comprovaram as hipóteses de Louis de Broglie.
Função de onda
Com a comprovação experimental da natureza ondulatória das partículas, e estabelecido o seu comprimento de onda 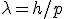 , o próximo passo foi descobrir qual grandeza física está associada à onda de matéria. Nenhuma grandeza física conhecida explica a natureza dessas ondas, então foi utilizada a letra grega Ψ para designar a função de onda da matéria.
, o próximo passo foi descobrir qual grandeza física está associada à onda de matéria. Nenhuma grandeza física conhecida explica a natureza dessas ondas, então foi utilizada a letra grega Ψ para designar a função de onda da matéria.
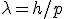 , o próximo passo foi descobrir qual grandeza física está associada à onda de matéria. Nenhuma grandeza física conhecida explica a natureza dessas ondas, então foi utilizada a letra grega Ψ para designar a função de onda da matéria.
, o próximo passo foi descobrir qual grandeza física está associada à onda de matéria. Nenhuma grandeza física conhecida explica a natureza dessas ondas, então foi utilizada a letra grega Ψ para designar a função de onda da matéria.
Em 1926, Erwin Schrödinger descobriu uma equação que permite encontrar a função de onda de uma partícula, a partir do conhecimento da energia potencial à qual esta está submetida.
Entretanto foi Max Born que, em 1928, descobriu a relação entre a função de onda e a probabilidade de se encontrar a partícula numa determinada posição. Ele concluiu que 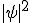 é a grandeza estatística que representa a densidade de probabilidade. Esta função dá a probabilidade de encontrarmos uma partícula numa determinada região do espaço.
é a grandeza estatística que representa a densidade de probabilidade. Esta função dá a probabilidade de encontrarmos uma partícula numa determinada região do espaço.
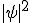 é a grandeza estatística que representa a densidade de probabilidade. Esta função dá a probabilidade de encontrarmos uma partícula numa determinada região do espaço.
é a grandeza estatística que representa a densidade de probabilidade. Esta função dá a probabilidade de encontrarmos uma partícula numa determinada região do espaço.
Com esta última descoberta, a Física Quântica mostra que a natureza possui um comportamento estatístico, sendo descrita por uma função que representa a probabilidade. Este fato incomodou muitos físicos, inclusive Einstein, que expressou sua insatisfação dizendo:
- Deus não joga dados com o Universo.
Entretanto os resultados experimentais dão o veredicto a favor da formulação quântica.
Equação de Schrödinger
 A Equação de Schrödinger permite calcular a função de onda Ψ (r,t), associada a uma partícula que se move dentro de um campo de forças descrito por um potencial V (r,t). No caso em que o potencial não depende do tempo, ela é expressa do seguinte modo:
A Equação de Schrödinger permite calcular a função de onda Ψ (r,t), associada a uma partícula que se move dentro de um campo de forças descrito por um potencial V (r,t). No caso em que o potencial não depende do tempo, ela é expressa do seguinte modo:
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
A resolução da Equação de Schrödinger conduz a um conjunto de funções de onda e a um conjunto de energias correspondentes aos estados do elétron permitidos no átomo. As expressões matemáticas das funções de onda possibilitam determinar a probabilidade de encontrar o elétron na vizinhança de um ponto próximo do núcleo.
No caso do átomo de hidrogênio, a energia potencial eletrostática é dada por
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
onde e é a carga elementar, εo é a constante elétrica de permissividade no vácuo e r é a distância ao centro do átomo. Este é um potencial no espaço tridimensional.
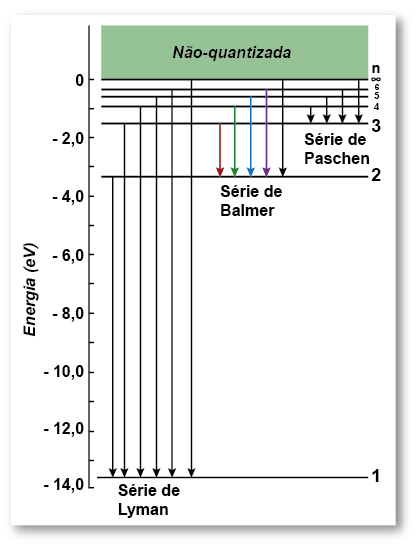
Energias do hidrogênio
A solução da Equação de Schrödinger para este potencial, que não apresentarei aqui, mostra que os valores de energia são quantizados, e são os mesmos obtidos pelo modelo de Bohr.
x
T l T l E l Fl dfG l
N l El tf l
P l Ml tfefel
Ta l Rl
Ll
Dl
| (Clique na imagem para ampliá-la) |
O nível n=1 é o estado fundamental, os outros níveis são estados excitados. O elétron pode receber energia e subir para um desses estados, mas depois de um curto intervalo de tempo volta para o estado fundamental.
Se o elétron estiver no nível fundamental e receber uma energia de pelo menos 13,61 eV, é arrancado do átomo. Temos, neste caso, um elétron livre e um íon do hidrogênio.
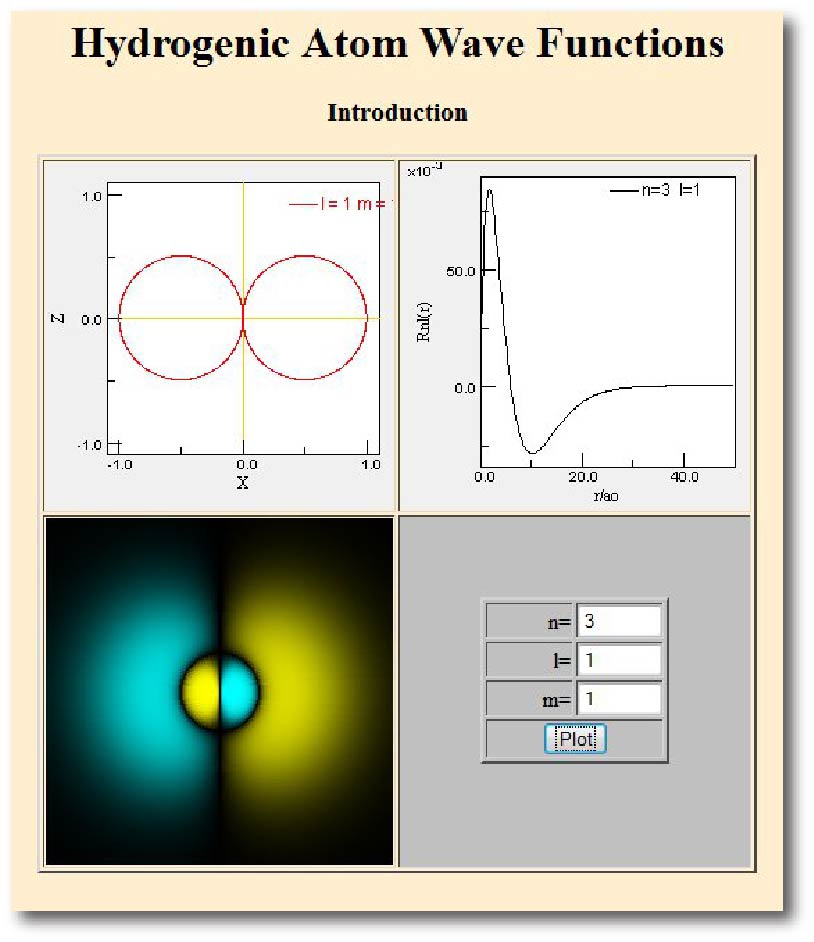
Mais números quânticos
As funções de onda, obtidas a partir da equação de Schrödinger, que descrevem os estados quantizados do átomo de hidrogênio, exigem três números quânticos, correspondentes às três dimensões em que o elétron pode se mover.
Números quânticos do átomo de hidrogênio
Utilize esta simulação (clique na figura) para ver as funções de onda para diferentes valores de (n, l, ml).
Nenhum comentário:
Postar um comentário